电解质与非电解质的比较与判断
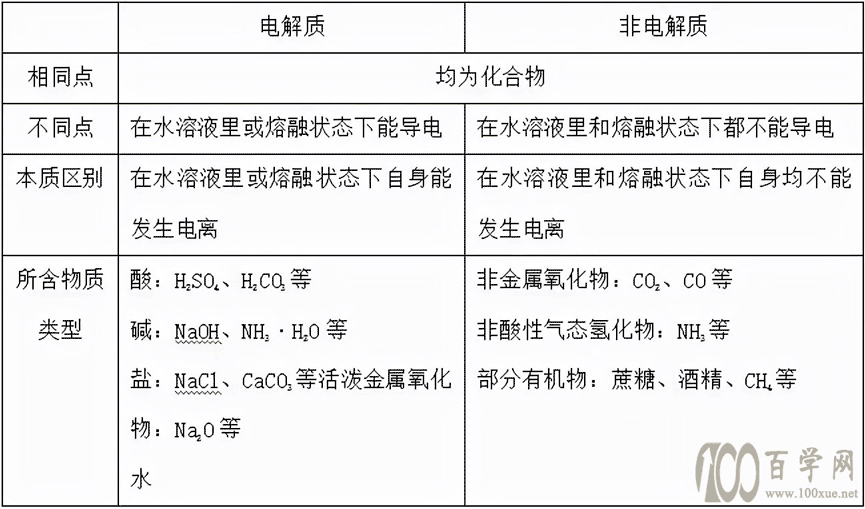
1.电解质和非电解质的比较
2.电解质的判断
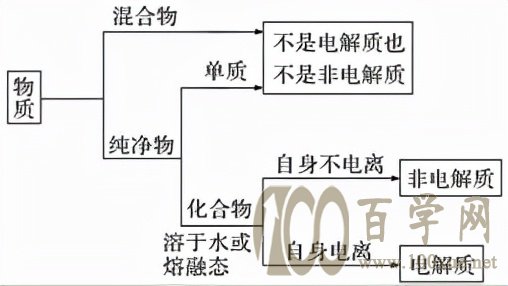
(1)从物质分类角度:电解质与非电解质都属于化合物。单质、混合物既不是电解质,也不是非电解质。
(2)从物质性质角度:电解质导电的条件是电解质溶于水或熔融状态下,二者具备其一即可。
①有些电解质溶于水导电,但熔融状态下不导电,如HCl气体。
②有些电解质只在熔融状态下才能导电,如BaSO4。
(3)判断物质是否为电解质的方法:
【特别提醒】理解电解质和非电解质的“不一定”
(1)溶于水能导电的化合物不一定是电解质,如CO2、SO2、SO3、NH3的水溶液能导电,但CO2、SO2、SO3、NH3本身不能直接电离产生离子,而是它们与H2O反应生成的H2CO3、H2SO3、H2SO4、NH3·H2O电离出自由移动的离子。H2CO3、H2SO3、H2SO4、NH3·H2O是电解质,CO2、SO2、SO3、NH3是非电解质。
(2)导电的物质不一定是电解质
①Fe、Cu等金属能导电,但它们是单质,不属于电解质,也不属于非电解质。
②稀盐酸能导电,但不属于电解质,因为稀盐酸为混合物。
(3)电解质不一定易溶于水,易溶于水的化合物不一定是电解质。BaSO4等难溶于水的盐,其水溶液的导电能力很弱,但其溶于水的部分完全电离,因而属于电解质。蔗糖易溶于水,但它是非电解质。
(4)不是电解质的不一定是非电解质,单质和混合物既不是电解质,也不是非电解质。
【重难点点睛】电解质和非电解质是从一个新的视角对化合物分类所得到的结果,分类的依据是化合物在溶于水或熔融状态下能否导电。
学习时注意把握三点:
(1)物质导电与电解质的关系,能导电的物质不一定是电解质,电解质不一定任何状态下都能导电。
(2)电解质是自身可电离出离子的化合物。
(3)单质和混合物既不是电解质也不是非电解质。
【重难点点睛】理解电解质的四个关键点
(1)物质范畴:化合物。
(2)导电条件:水溶液或熔融状态。
(3)导电本质:自身发生电离。
(4)常见物质:酸、碱、盐、活泼金属氧化物、水。
本站(www.100xue.net)部分图文转自网络,刊登本文仅为传播信息之用,绝不代表赞同其观点或担保其真实性。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系(底部邮箱),我们将及时更正、删除,谢谢

